今天就带大家系统地了解一下它们是什么、为什么重要,以及在计算中该如何使用。
一、什么是“基函数”?
👉 可以这样理解:
-
每一个基函数就像一块“电子云积木”;
-
你用越多、越灵活的积木块,就越能拼出接近真实的电子分布。
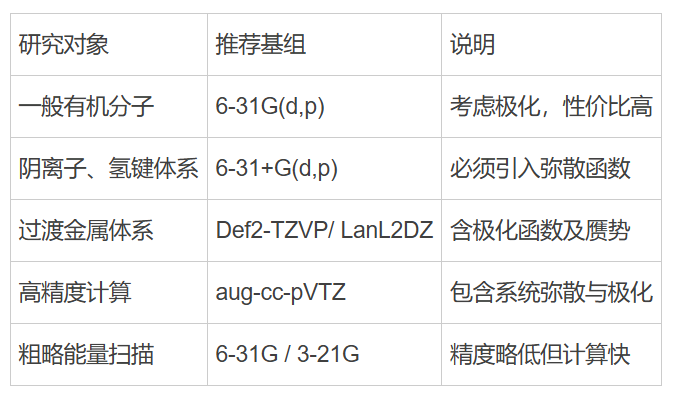
在常见的基组体系中,STO-3G 或 6-31G 是最基础的。
其中“6-31G”表示:
-
内层电子用 6 个高斯函数拟合;
-
价层电子分为两部分(3 + 1),即所谓的“双ζ基组”或“劈裂价键基组”。
这种基组能较好地描述原子的基本电子结构,但仍然存在两个显著问题:
-
电子云太“僵硬” ——无法很好地反映键角、键长的细微变化;
-
电子分布太“集中” ——难以描述远离原子的电子行为。
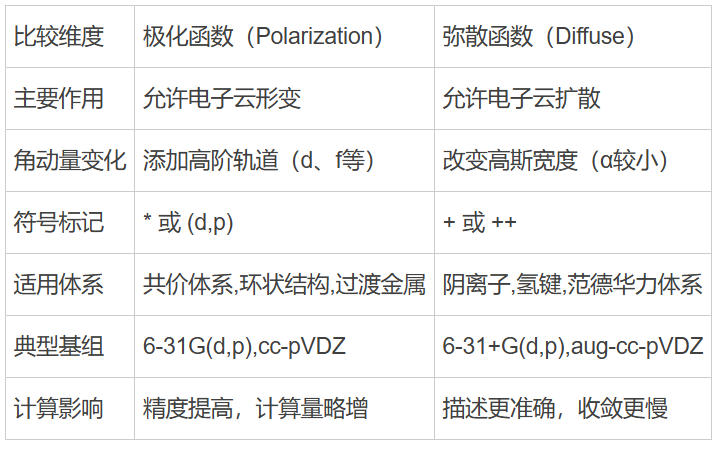
于是,科学家就在这些基础基组的“骨架”上做了两种改进:一种是让电子云能“形变”(极化函数),另一种是让电子云能“飘远”(弥散函数)。
二、极化函数
🔬 1. 极化函数的原理
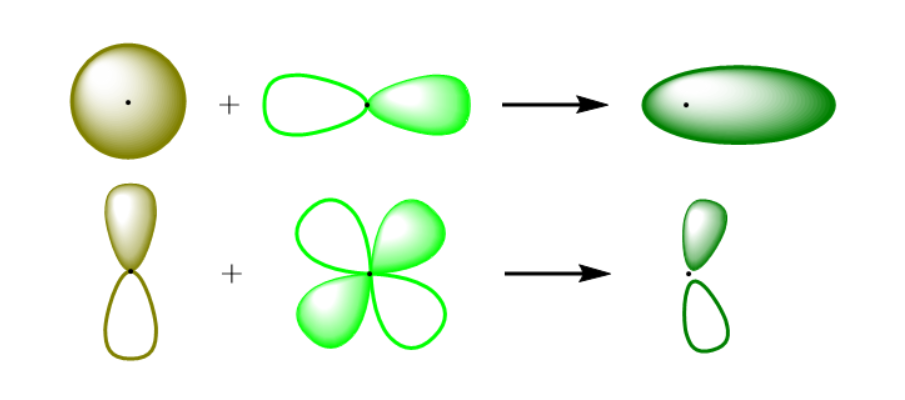
极化函数的本质是在基组中添加更高角动量的轨道。
例如:
-
对氢(H)这种只有 s 轨道的原子,加入 p 轨道函数;
-
对碳、氧、氮等第二周期元素,加入 d 轨道函数;
-
对过渡金属元素,则可加入 f 轨道函数。
这些额外的函数本身在基态中没有电子占据,但它们允许电子波函数在外界扰动下发生偏移,从而更真实地反映化学键的极化和分子间的电荷重新分布。
🧮 2. 表示方法与符号含义
极化函数通常用“*”或“(d,p)”表示。
-
6-31G* :只对重原子加极化函数(例如碳、氧);
-
6-31G**:对重原子和氢原子都加上极化函数。
🌟 多一个“*”,就代表多考虑了一层电子形变。
这类基组在描述几何构型、偶极矩、振动频率时会显著提高精度。
🧫 3. 举个实际的例子
以水分子为例,若仅用 6-31G 基组计算,其 O–H 键长会略短、键角偏大。但加入极化函数(6-31G(d,p))后,计算出的键长与实验值几乎吻合。原因就在于极化函数让电子云在氧原子附近能随氢原子方向“偏移”——更接近真实的极化效应。
三、弥散函数
比如阴离子、氢键、范德华相互作用体系,电子分布往往比较“松散”,甚至延伸到较远的空间。普通基组的函数太集中,无法描述这些“远离核区”的电子行为。这时候,就要引入弥散函数(Diffuse Function)。
1. 数学原理
高斯型基函数的形式为:
ψ(r)=e−αr2psi(r) = e^{-alpha r^2}
其中 α 控制函数的“宽度”:
-
α 大 → 函数紧密集中;
-
α 小 → 函数扩散延伸。
弥散函数就是选取α 较小的高斯函数,让电子云分布得更宽、更远。
这样可以更好地描述电子的离域效应和弱相互作用。
2. 表示方法与符号
弥散函数用“+”号来表示:
-
6-31+G(d) :对重原子加入弥散函数;
-
6-31++G(d,p) :对重原子和氢原子都加上弥散函数。
➕ 多一个“+”,电子云“飘”得更远。
这在计算阴离子、分子复合物或氢键体系时尤为重要。
3. 应用实例
-
阴离子体系:
没有弥散函数,电子可能会被“挤回”原子核附近,导致能量偏高。 -
非键相互作用体系(如分子间氢键):
弥散函数能准确描述弱电荷分布和相互作用能。
 芯耀
芯耀




 286
286