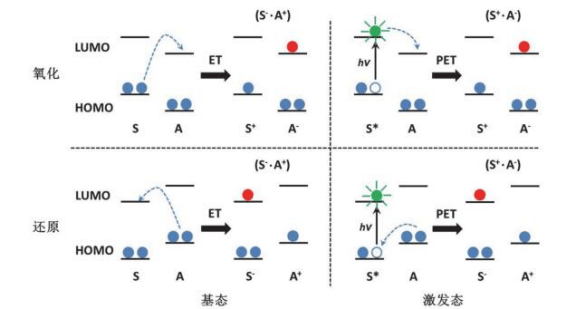
一、HOMO 与 LUMO 是什么?
HOMO(Highest Occupied Molecular Orbital):最高已占据分子轨道,常对应最易被氧化或易失电子的能级。
LUMO(Lowest Unoccupied Molecular Orbital):最低未占据分子轨道,常对应最易被还原或易接受电子的能级。
两者统称“前线轨道(Frontier Orbitals)”。它们的能量差(能隙 ΔE)决定了分子被激发或发生反应的“难易度”。
二、为什么重要?三个高频应用
(1) 、反应性预测:反应通道往往由反应物的 HOMO 与另一方的 LUMO 主导;能量接近、对称性匹配且空间重叠良好时更有利于反应的发生,同时可以结合Fukui 函数、局部软硬度 做位点选择性预测。
(2) 、光谱与发光:最简跃迁可近似为 HOMO→LUMO,能隙对应吸收/发射波长的粗略位置。
(3) 、电化学与能级:氧化电位常与 ε(HOMO) 相关,还原电位与 ε(LUMO) 相关;在固体中,类比为价带顶与导带底。
三、一个直观例子:共轭 π 系统的 HOMO→LUMO 激发

随着共轭长度增加,前线能级间距总体缩小,吸收/发射发生长波移。
取代基的给受电子效应会抬高或降低 HOMO/LUMO,从而调控颜色与反应活性。
在有机发光材料与染料设计中,适度的 HOMO/LUMO空间分离可降低交换能、调控三重态收发率。
四、如何“看见”与“估算” HOMO/LUMO?
实验侧:
- 循环伏安(CV):将氧化/还原起始电位换算到真空能标,近似估 ε(HOMO)和ε(LUMO),须注明参比电极、溶剂/电解质与温度并做校正。
- UV-Vis/PL:吸收边与发射峰反映光学隙与斯托克斯位移;先由 CV 定位 HOMO,再用带隙估 LUMO。
计算侧:
- 量化化学(DFT/HF/半经验):输出轨道能量与等值面,Koopmans 近似在 HF 更成立,DFT 仅作定性。
- 开壳层体系注意 SOMO/自旋分辨;溶剂、色散校正、构型与扭转角都会显著影响前线能级与隙,应在相同条件下对比。
 芯耀
芯耀



 1981
1981





